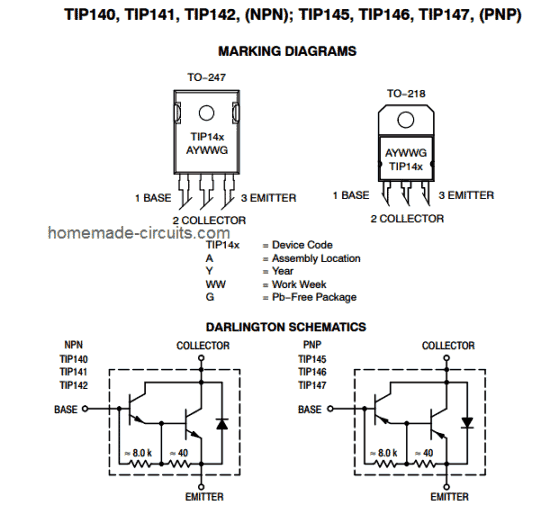
En tør celle er den enkleste form for elektricitetsproducerende kilde. Et antal celler kombineret celler danner sammen et batteri. Det bly-syre eller nikkel-cadmium batteri er den avancerede version af tørcelle. Denne celle blev først opfundet af den franske ingeniør Georges Leclanche i år 1866. Hans opfindelse blev opkaldt efter hans navn som Leclanche-batteri. Men på det tidspunkt var det meget tungt og kunne let brydes. En tør celle har det samme princip, og det er den avancerede version af Leclanche-batteriet og kommer i forskellige spændinger og størrelser. Den kommercielle form for zink-carbon-cellen, som er den modificerede form for Leclanche-batteriet, blev opfundet i 1881 af Carl Gassner fra Mainz. Det produceres i store mængder og bruges i mange applikationer som legetøj, radioer, regnemaskiner osv.
Hvad er en tør celle?
En tør celle er en enhed, der genererer elektricitet baseret på kemiske reaktioner. Når de to elektroder i cellen er forbundet via en lukket sti, tvinger cellen elektronerne til at strømme fra den ene ende til den anden. Strømmen af elektroner får strømmen til at strømme i det lukkede kredsløb.

Lag af tørre celler
Ved hjælp af kemiske reaktioner strømmer elektronerne fra den ene ende til den anden. Når to eller flere celler, der er forbundet med korrekt polaritet, strømmer flere elektroner på grund af højt potentiale. Denne kombination kaldes et batteri. Fra en minimumspænding på 1,5 V til 100 V kan et batteri bruges til at opnå en række spændinger. Selv udgangsspændingen på batteriet kan reguleres til forskellige niveauer ved hjælp af strømelektroniske omformere som f.eks helikopter kredsløb.
Struktur af celle
Strukturen af den zink-carbon tørre celle er vist i figuren. Den består af anodeterminalen som zink eller generelt grafitstang. Kulstoffet danner katodeterminalen. Det kan observeres, at zink i ældre versioner af tørcelle blev brugt som katode, og grafit blev brugt som anodeterminal. Valget af grundstoffer er grundlæggende baseret på dets kemiske konfiguration af elementernes yderste bane.

Tør celle struktur
Hvis den har flere antal elektroner i den yderste bane, kan den fungere som en donor og dermed danne katoden. Tilsvarende, hvis den yderste bane har færre elektroner, kan den let acceptere og dermed danne anoden. Elektrolytten placeret imellem fungerer som en katalysator for de kemiske reaktioner. Generelt bruger vi ammoniumchloridgelé som elektrolyt. I den viste figur er den anvendte elektrolyt en blanding af zink og chlorid. Også natriumchlorid bruges også som en elektrolyt. En blanding af mangandioxid og kulstof er omgivet af anodestangen.
Hele konfigurationen er placeret i et metalrør. Geléen forhindres i at tørre op ved hjælp af en tonehøjde øverst i cellen. En kulskive placeres i bunden. Formålet med denne vaskemaskine er at forhindre, at zinkanodestangen kommer i kontakt med beholderen.
Dette kaldes også en afstandsstykke som vist i diagrammet. Zinkdåsen er også omgivet af papirisolering til isoleringsformål. Til store batterier anvendes også andre isoleringsmaterialer som glimmer osv. Ellens positive terminal dannes øverst. Den negative terminal af cellen dannes ved basen.
Arbejde af tør celle
En tør celle fungerer grundlæggende på kemiske reaktioner. På grund af reaktionerne, der finder sted mellem elektrolytten og elektroderne, strømmer elektronerne fra den ene elektrode til den anden. Stoffer såsom syrer opløses i vand til dannelse af ioniserede partikler. Den ioniserede partikel er af to typer. De positive ioner kaldes kationer, og de negative ioner kaldes anioner. Syrerne, der er opløst i vand, kaldes elektrolytter.
I det ovennævnte diagram dannes zinkchloridet som elektrolyt. Tilsvarende dannes ammoniumchloridgelé også som en elektrolyt. Metalstængerne nedsænket i elektrolytter danner elektroder. Baseret på metalstængernes kemiske egenskaber har vi en positiv elektrode som anode og en negativ elektrode som katoden.
Elektroderne tiltrækker de modsat ladede ioner til deres side. For eksempel tiltrækker katoden anionerne, og anoden tiltrækker kationerne. I denne proces strømmer elektronerne fra den ene retning til den anden, derfor får vi en strøm af ladninger. Dette kaldes nuværende .
Kemiske reaktioner
Reaktionerne, der finder sted i cellen, er vist nedenfor. For det første er oxidationsreaktionen.

I dette oxideres zinkkatoden til positivt ladede zinkioner, der frigiver to ioner. Disse elektroner opsamles af anoden. Så kommer reduktionsreaktionen.

Reduktionsreaktionen ved anoden er vist ovenfor. Denne reaktion producerer en elektrisk strøm. Det frigiver oxidioner med magnesiumoxid. Denne reaktion dannes, når magnesium kombineres med elektrolytten.


De to andre reaktioner repræsenterer en syre-base reaktion og udfældning reaktion, der finder sted i den tørre celle. I syre-base-reaktionen kombineres NH med OH for at producere NH3 sammen med vand. Resultaterne er NH3 og vandbase.
Forskellen mellem en tør celle og en våd celle
Hovedforskellen mellem den tørre celle og den våde celle er formen af elektrolyt. Som tidligere beskrevet er elektrolytten, såsom ammoniumchlorid, i en tør celle tør af natur. Sådanne tørre celler er mere almindelige og bruges i legetøj, radioer osv. Men i en våd celle er elektrolytten i flydende tilstand.
Der anvendes flydende elektrolytter såsom svovlsyre, som er en farlig ætsende væske. På grund af sådanne væskers natur er den våde celle mere eksplosiv og skal håndteres med forsigtighed. Den bedste fordel ved sådanne våde celler er, at de let kan genoplades og bruges til adskillige applikationer. Sådanne batterier finder almindelig anvendelse i luftfart, forsyningsselskaber, energilagring og mobiltelefontårne.
Tørcellefunktioner
Den tørre cellefunktion er baseret på de kemiske reaktioner mellem elektroden og elektrolytterne. Når elektroderne placeres i elektrolytterne, tiltrækker det de modsat ladede ioner mod sig selv. Dette forårsager strømmen af ladninger, og dermed produceres strøm.
Fordele
Det fordelene ved den tørre celle inkluderer følgende.
- Den tørre celle har adskillige fordele såsom
- Det er lille i størrelse.
- Det kan komme i forskellige spændingsniveauer.
- Det er praktisk og har adskillige applikationer.
- Det er den eneste kilde til jævnstrømsspænding.
- Det kan bruges sammen med elektriske elektroniske kredsløb til at regulere udgangsspændingen
- Det er genopladeligt.
Ulemper
Det ulemper ved den tørre celle inkluderer følgende.
- Det skal håndteres med forsigtighed
- Det er eksplosivt
- Store batterier er meget tunge
Ansøgninger
Det anvendelser af den tørre celle inkluderer følgende.
- Legetøj
- Luftfart
- Mobiltelefoner
- Radio
- Lommeregner
- Ure
- Høreapparater
Derfor har vi set betjeningen, klassificeringen og anvendelserne af tørre celler . Et interessant punkt at bemærke er, at batteriet kun fungerer, når elektroderne er fysisk i kontakt med hinanden. Der skal eksistere et ledende medium mellem de to elektroder. Spørgsmålet er, om vand kan bruges som et ledende medium mellem tørcellens elektroder? I så fald hvad sker der, hvis denne celle dyppes i vand?